令和3年6月30日より、「人を対象とする生命科学・医学系研究に関する倫理指針(以下、生命・医学系指針)」が施行されました。
この新たな生命・医学系指針は、従来の「人を対象とする医学系研究に関する倫理指針」と「ヒトゲノム・遺伝子解析研究に関する倫理指針」を統合し、新たに施行された臨床研究実施に関する倫理指針です。
令和3年11月8日から令和3年12月7日にかけ、「個人情報の保護に関する法律(以下、個人情報保護法)」の改正に基づく生命・医学系指針の改正に向けたパブリックコメントが募集され、今後も適宜指針の改正が予定されております。
本記事では、今後の改正に向け、令和3年6月30日に施行された、生命・医学系指針のポイントを改めて解説したいと思います。
生命・医学系指針(令和3年6月30日施行)について
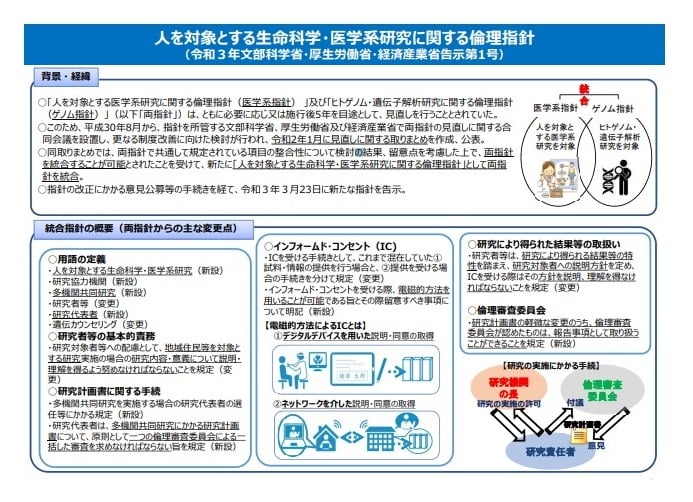
出典:「「人を対象とする生命科学・医学系研究に関する倫理指針」説明資料」(厚生労働省))(令和4年1月12日に利用)
【主な変更点】
・用語の定義・研究者等の基本的責務
・研究計画書に関する手続
・インフォームド・コンセント
・研究により得られた結果等の取扱い など
今回の指針の統合によって、混沌としていた運用がシンプルまたは効率的となったものもある一方、より複雑な判断が必要となったケースもあるなど、注意が必要です。
生命・医科学系指針(令和3年6月30日施行)改正のポイント
研究実施体制の明確化
研究計画の倫理審査委員会への付議やその他の研究実施に係る手続が、「研究機関の長」から「研究責任者」が主体となって行われるよう変更した。
多機関共同研究の体制整備
多機関共同研究を実施する際には、倫理審査に係る手続の効率化を図るため、一括審査を原則とした。
研究協力機関の定義
研究計画書に基づいて研究が実施される研究機関以外であって、当該研究のために研究対象者から新たに試料・情報を取得し(侵襲(軽微な侵襲を除く。)を伴う試料の取得は除く。)、研究機関に提供のみを行う機関をいう。
インフォームド・コンセント(IC)の利便性向上
研究者等又は既存試料・情報の提供のみを行う者は、次に掲げる全ての事項に配慮した上で、1(弊社注釈、生命・医学系指針 第8の1)における文書によるインフォームド・コンセントに代えて、電磁的方法によりインフォームド・コンセントを受けることができる。
① 研究対象者等に対し、本人確認を適切に行うこと。
② 研究対象者等が説明内容に関する質問をする機会を与え、かつ、当該質問に十分に答えること。
③ インフォームド・コンセントを受けた後も5(弊社注釈、生命・医学系指針 第8の5)の規定による説明事項を含めた同意事項を容易に閲覧できるようにし、特に研究対象者等が求める場合には文書を交付すること。
① 研究対象者等に対し、本人確認を適切に行うこと。
② 研究対象者等が説明内容に関する質問をする機会を与え、かつ、当該質問に十分に答えること。
③ インフォームド・コンセントを受けた後も5(弊社注釈、生命・医学系指針 第8の5)の規定による説明事項を含めた同意事項を容易に閲覧できるようにし、特に研究対象者等が求める場合には文書を交付すること。
研究により得られた結果等の取扱いの明記
「研究に係る相談」とは、個別の研究計画や研究実施に関する手続の相談から、研究により得られた結果等に関する相談まで幅広く想定する必要がある。診断や治療に関するカウンセリングは医療現場で行われるものであり、すぐに連携できる体制を整備することが求められる。研究実施においては、研究責任者が当該研究における相談窓口を設置するなどして、相談を行うことができるようにする必要がある。
試料・情報の提供を行う機関において、カウンセリング体制が整備されていない場合に、研究対象者及びその家族又は血縁者からカウンセリングの求めがあったときには、そのための適切な施設を紹介することとする。
試料・情報の提供を行う機関において、カウンセリング体制が整備されていない場合に、研究対象者及びその家族又は血縁者からカウンセリングの求めがあったときには、そのための適切な施設を紹介することとする。
今後の改正に向けて
現在、個人情報保護法改正の観点から生命・医学系指針の改正が予定されております。
特にCOVID-19の影響により、各種デジタルツールの活用が進む現在では、利便性向上による研究の効率化と共に、個人情報保護についてはより一層厳格に管理されねばなりません。
引き続き当社でも臨床研究法並びに生命・医学系指針の趨勢に注目し、皆様のお役に立つ情報をお届けしてまいります。









.png?width=733&height=412&name=IPC_%E3%82%BB%E3%83%83%E3%82%B7%E3%83%A7%E3%83%B3KV_%E3%83%9F%E3%82%AF%E3%82%B9(%E5%86%8D%E7%94%9F%E3%83%9C%E3%82%BF%E3%83%B3%E5%85%A5%E3%82%8A).png)