| 本記事は、ADCの研究開発の現状についてまとめたもので、承認外の推奨を意図するものではありません。 |
ADCとは?
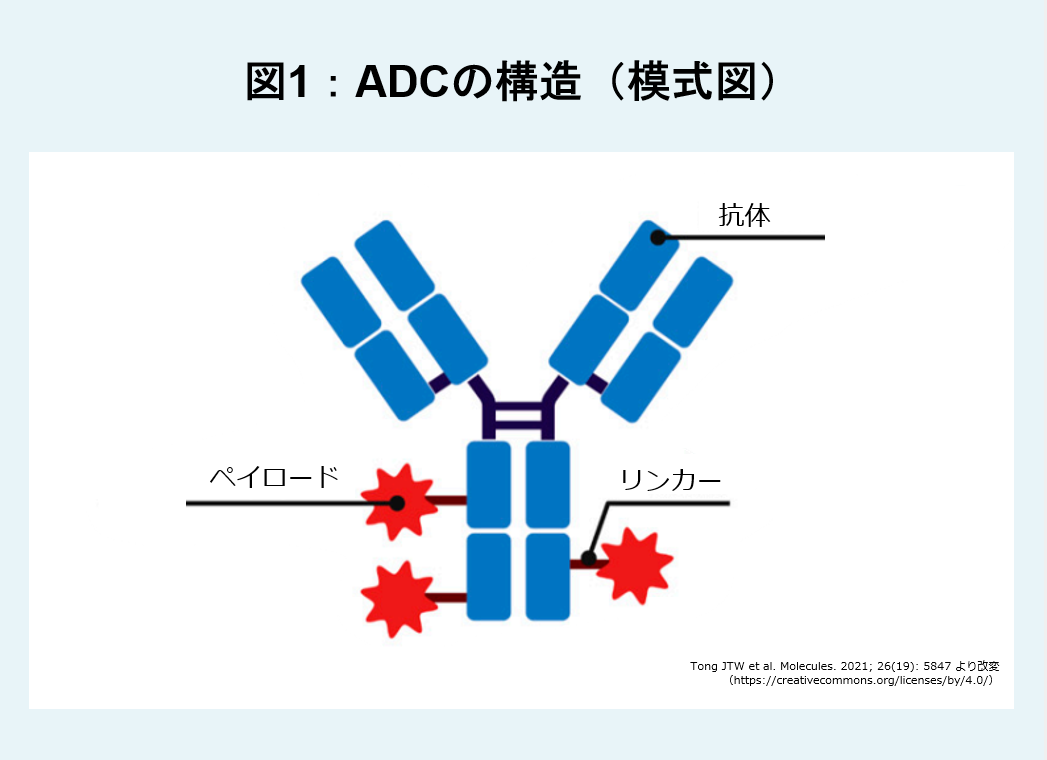
がんの薬物治療には「細胞傷害性抗がん薬」「ホルモン療法薬」「分子標的薬」などが使われています。「細胞傷害性抗がん薬」は、がん細胞を攻撃する効果は高いものの、がん細胞以外の正常な細胞も攻撃してしまいます。「ADC(antibody-drug conjugate:抗体薬物複合体)」は、強力な細胞傷害作用を持つ低分子薬物(ペイロード)を抗体に結合させたバイオ医薬品です(図1)。がん特異的抗原をターゲットとする抗体を用いることにより、標的となるがん細胞に局所的にペイロードを集中させることができるため、全身療法に比べて高い治療効果と広い安全域が期待されます。
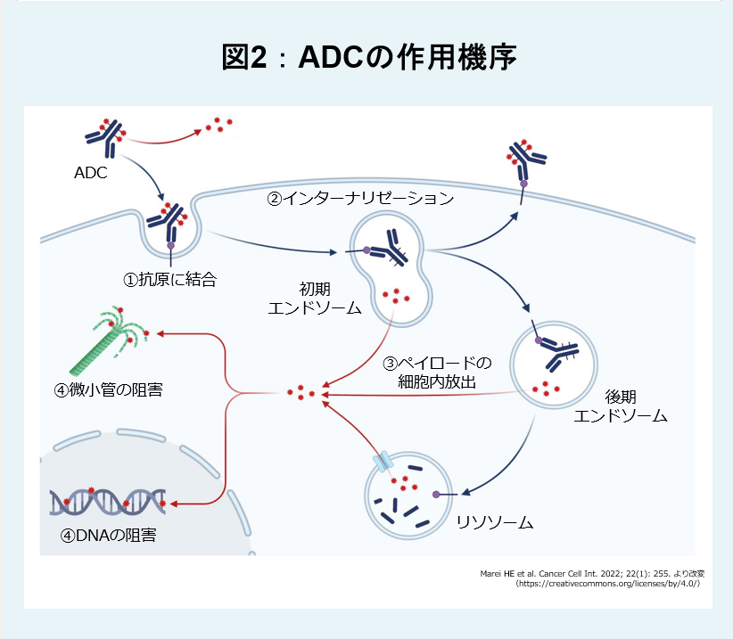
ADCの作用機序(図2)
ADCは高分子であるため、正常な血管を透過することはできません。しかし、がん新生血管では血管内皮細胞の間に隙間が存在しているため、enhanced permeability and retention(EPR)効果によってADCが透過できます1)。
新生血管を透過してがん細胞に到達したADCは、表面に発現している抗原に結合します(①)。すると、ADC-抗原複合体がエンドサイトーシスにより細胞内に取り込まれ(②インターナリゼーション)、次いで細胞内での還元作用やリソソーム内の酵素の働きなどにより抗体とペイロードの接続部であるリンカーが切断されて、ペイロードが細胞内に放出されます(③)。ペイロードは、主に、細胞の骨格を形成している微小管を阻害したり、DNAを切断・複製阻害したりすることにより、がん細胞の細胞死を引き起こします(④)1)。さらにペイロードが細胞外へと拡散し、周囲の細胞を攻撃する場合もあります(バイスタンダー効果)2)。
ADCに搭載されたさまざまなペイロード
2023年3月現在、国内で承認されたADCは表1のとおりです。
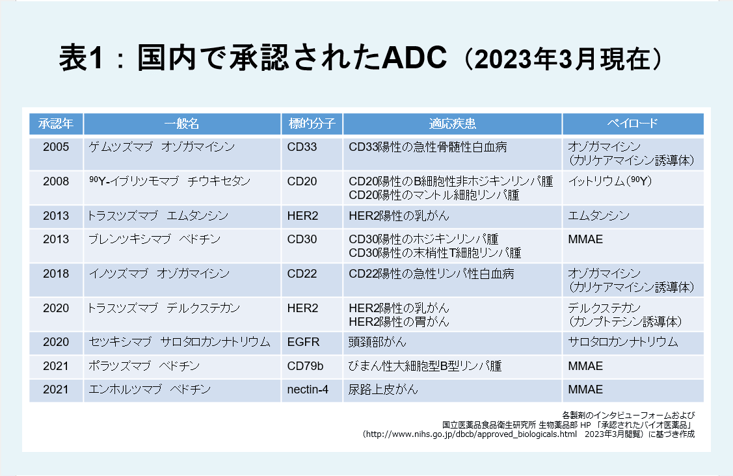
ADCの適応疾患は標的分子によって異なります。またペイロードにもさまざまな種類があり、3つに大別されます。
(A)細胞の骨格を形成している微小管を阻害するもの(MMAE、MMAF、エムタンシンなど)
(B)DNAを切断(オゾガマイシン:カリケアマイシン誘導体など)または複製を阻害する(デルクステカン:カンプトテシン誘導体など)もの
(C)その他
その他の例としては、キレート剤に付加した放射性同位体からベータ線を照射し抗腫瘍効果を発揮するADC(90Y-イブリツモマブ チウキセタン)3)や、波長690nmのレーザー光照射により励起されたIR700(光感受性物質)が光化学反応を起こして腫瘍細胞の細胞膜を傷害することにより殺細胞効果を示すと考えられているADC(セツキシマブ サロタロカンナトリウム)4)があります。
2021年の時点において、米国食品医薬品局(FDA)で承認されたADCは12種類5)、臨床試験で検討中のADCは100種類を超えるとされ6)、今後もさまざまなADCが治療選択肢の幅を広げるものと期待されています。
#02では乳がん治療のアンメットニーズの克服に挑むADCをご紹介します。
【参考文献】
1)Manabe S. Drug Delivery System. 2019; 34(1): 10-21.
2)Staudacher AH and Brown MP. Br J Cancer. 2017; 117(12): 1736-1742.
3)ゼヴァリンⓇイットリウム(90Y)静注用セット インタビューフォーム
4)アキャルックスⓇ点滴静注 インタビューフォーム
5)Wu M et al. Exp Hematol Oncol. 2022; 11(1): 93.
6)Yamazaki CM et al. Nat Commun. 2021; 12(1): 3528.
 |
M3DCメディカルライターチーム コンテンツ制作における文献調査や原稿執筆、学術チェックなどを行う。本サイトでは製薬業界や医薬品関連情報、その他お役立ち情報を発信。 |









.png?width=733&height=412&name=IPC_%E3%82%BB%E3%83%83%E3%82%B7%E3%83%A7%E3%83%B3KV_%E3%83%9F%E3%82%AF%E3%82%B9(%E5%86%8D%E7%94%9F%E3%83%9C%E3%82%BF%E3%83%B3%E5%85%A5%E3%82%8A).png)