 分子標的薬、免疫チェックポイント阻害薬などの登場により、がんの治療選択肢は増えています。一方で根治は難しく、いかにして再発や治療抵抗性を抑えるかが課題となっています。治療抵抗性の一因とされる腫瘍内の不均一性を克服すべく、どのような抗体薬物複合体(ADC)が開発されているのか、乳がんに焦点をあてて紹介します。
分子標的薬、免疫チェックポイント阻害薬などの登場により、がんの治療選択肢は増えています。一方で根治は難しく、いかにして再発や治療抵抗性を抑えるかが課題となっています。治療抵抗性の一因とされる腫瘍内の不均一性を克服すべく、どのような抗体薬物複合体(ADC)が開発されているのか、乳がんに焦点をあてて紹介します。| 本記事は、ADCの研究開発の現状についてまとめたもので、承認外の推奨を意図するものではありません。 |
乳がん治療の進歩
乳がんは女性が罹患するがんの中で最も頻度が高く、2019年には新たに約9万8千例が乳がんと診断されました1)。乳がんの治療は薬物療法、外科療法、放射線療法を組み合わせて行われており、薬物療法には、ホルモン療法、化学療法、分子標的薬や免疫チェックポイント阻害薬などが用いられています。新規薬剤の登場により治療選択肢が増え、ホルモン受容体やHER2(ヒト上皮増殖因子受容体2型)の有無、また遺伝子プロファイルに応じた個別化治療が進み、2022年には4年ぶりに「乳癌診療ガイドライン」が改訂されました。
乳がん治療におけるアンメットニーズ:腫瘍内不均一性と治療抵抗性
一方で、課題もあります。その一つが腫瘍内不均一性です。
正常な細胞において、がんの原因となる遺伝子(ドライバー遺伝子)に変異が生じると、細胞ががん化します。遺伝子の変異はランダムに起こるため(中立進化)、一つの腫瘍の中には複数のサブクローンが存在する可能性があります(腫瘍内不均一性)。ある薬剤により大部分のクローンが淘汰されても、別のクローンは生き残り、さらなる進化を続けるため、治療抵抗性が生じると考えられています2)(図1)。
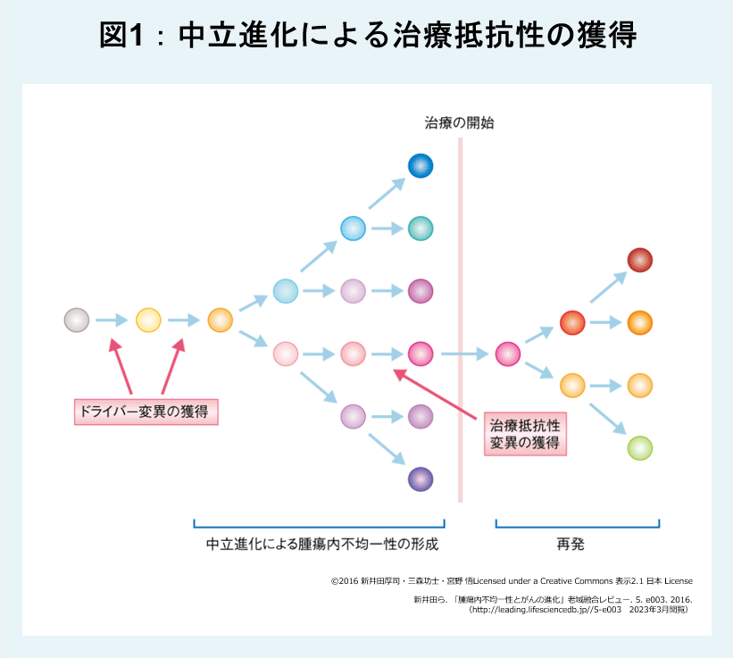
乳がんではHER2遺伝子がドライバー遺伝子として知られています。HER2陽性患者においては、各報告ごとに数値の幅があるものの一定の割合で腫瘍内のHER2の発現レベルが不均一であると報告されています3-6)。この不均一性のために、HER2を標的とする薬剤で治療を開始しても、HER2の発現レベルが高くない細胞がclonal evolutionを起こして、治療抵抗性が現れる可能性が否定できません。
治療抵抗性を克服する手段として注目されているのが、ADCのバイスタンダー効果、すなわち、標的となる細胞だけでなく周囲の細胞にも抗腫瘍活性を発揮する効果です。HER2を標的とするADCの中にもバイスタンダー効果を高めるよう設計されたものがいくつかあります。
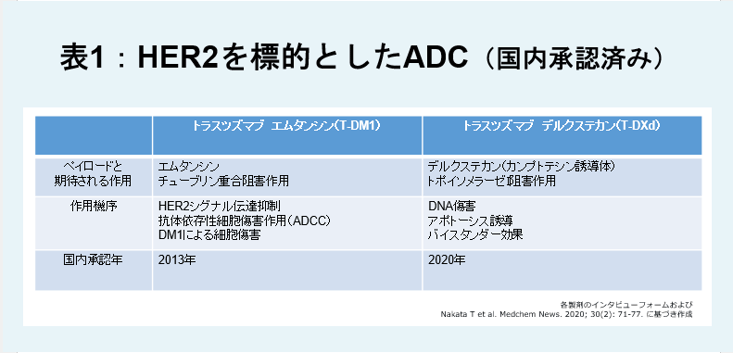
HER2を標的にしたADC(国内承認済み 表1)
トラスツズマブ エムタンシン(T-DM1)
抗HER2抗体トラスツズマブに微小管阻害薬エムタンシンを結合させたADCです。トラスツズマブ自体が有するHER2シグナル伝達の抑制や抗体依存性細胞傷害作用(ADCC)活性の誘導などに加え、DM1を標的細胞に対して選択的に作用させることにより、細胞傷害活性を発揮すると考えられています7)。日本では2013年に承認されました。
トラスツズマブ デルクステカン(T-DXd)
トラスツズマブにDNAの複製を阻害するデルクステカンを結合させたADCです。腫瘍細胞の細胞膜上に発現するHER2に結合して細胞内に取り込まれた後、リンカーが加水分解され、遊離したMAAA-1181aがDNA傷害作用およびアポトーシス誘導作用を示すことなどにより、腫瘍増殖抑制作用を示すと考えられています8)。デルクステカンは膜を透過するため、周囲の細胞に対しても抗腫瘍活性を発揮します(バイスタンダー効果)9)。日本では2020年に承認されました。
HER2を標的にしたADC(未承認)
非臨床段階で抗腫瘍活性が報告されているADCのうち、HER2を標的とし、バイスタンダー効果を有するものの一部をご紹介します。
複数種のペイロードを結合したADC
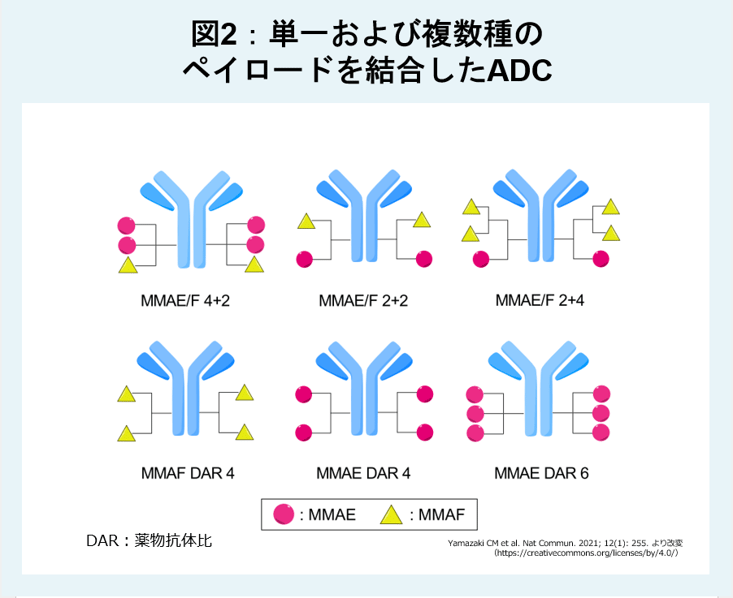
トラスツズマブに微小管阻害薬であるMMAEとMMAFの両方を結合したADCの開発が進んでいます(図2)。膜透過性によりバイスタンダー効果を有するMMAEとバイスタンダー効果を持たないMMAFの両方を有することにより、複数のサブクローンを相補的に殺傷するという発想10)で設計されたADCです。HER2発現が不均一なマウス腫瘍モデルにおいて、MMAEとMMAFの両方を結合したADC(MMAE/F 4+2)は、MMAEのみのADC(MMAE DAR4)とMMAFのみのADC(MMAF DAR4)を同時に併用投与した場合に比べて、抗腫瘍活性が高いことが報告されています11)。
光感受性物質を結合したADC
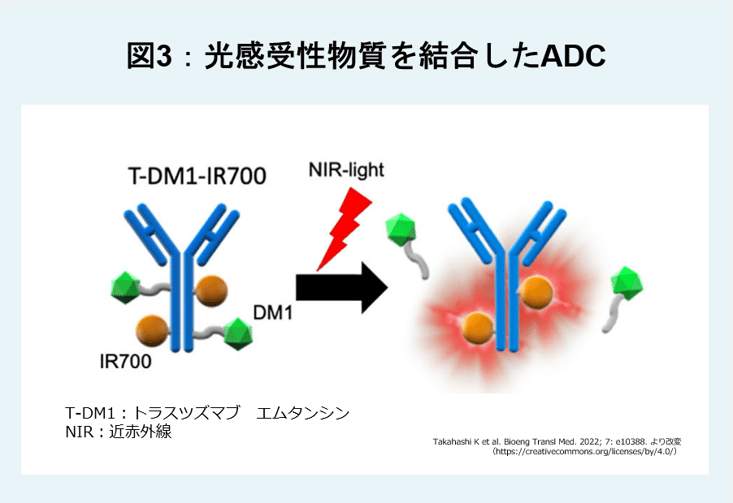
一般に、バイスタンダー効果はペイロードの膜透過性によりもたらされますが、膜を透過しないペイロードにバイスタンダー効果を付加する技術も開発されています。例えば、前述のトラスツズマブ エムタンシン(T-DM1)において、細胞内で放出されたDM1は膜透過性を持たないため細胞内にとどまります。一方、T-DM1に光感受性物質IR700を結合させたT-DM1-IR700に近赤外光照射を行うと、抗体からDM1を放出することが可能です(図3)。放出されたDM1は周囲の細胞を殺傷し、残った抗体は標的細胞の細胞死を誘導します。HER2発現が不均一なマウス腫瘍モデルにおいて、T-DM1-IR700投与および近赤外光照射による腫瘍抑制効果および生存期間の延長が報告されています12)。
今後の展望
抗HER2抗体をベースとした次世代型ADCには、トラスツズマブにDNAの複製を妨げるデュオカルマイシンを結合させたものや、トラスツズマブ以外の抗HER2抗体(例:ペルツズマブ)を用いたものなどもあり、海外で臨床試験が進行中です13)。
今後も、さまざまなADCの開発が進み、治療抵抗性を示す乳がん患者における治療選択肢の拡大につながることが期待されます。
【参考文献】
1)国立研究開発法人 国立がん研究センター 「がん情報サービス がん統計」
https://ganjoho.jp/reg_stat/statistics/stat/cancer/14_breast.html (2023年3月閲覧)
2)Uchi R et al. PLoS Genet. 2016; 12(2): e1005778.
3)Seol H et al. Mod Pathol. 2012; 25(7): 938-948.
4)Glöckner S et al. Lab Invest. 2002; 82(10): 1419-1426.
5)Shin SJ et al. Int J Surg Pathol. 2006; 14(4): 279-284.
6)Brunelli M et al. Am J Clin Pathol. 2009; 131(5): 678-682.
7)カドサイラⓇ点滴静注用 インタビューフォーム
8)エンハーツⓇ点滴静注用 インタビューフォーム
9)Nakata T et al. Medchem News. 2020; 30(2): 71-77.
10)Levengood MR et al. Angew Chem Int Ed. 2017; 56: 733-737.
11)Yamazaki CM et al. Nat Commun. 2021; 21: 3528.
12)Takahashi K et al. Bioeng Transl Med. 2022; 7: e10388.
13)Ferraro E et al. Breast Cancer Res. 2021; 23(1): 84.
 |
M3DCメディカルライターチーム コンテンツ制作における文献調査や原稿執筆、学術チェックなどを行う。本サイトでは製薬業界や医薬品関連情報、その他お役立ち情報を発信。 |









.png?width=733&height=412&name=IPC_%E3%82%BB%E3%83%83%E3%82%B7%E3%83%A7%E3%83%B3KV_%E3%83%9F%E3%82%AF%E3%82%B9(%E5%86%8D%E7%94%9F%E3%83%9C%E3%82%BF%E3%83%B3%E5%85%A5%E3%82%8A).png)